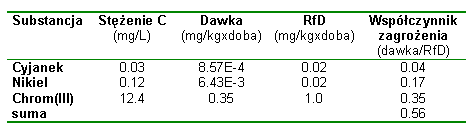ekotoksykologia
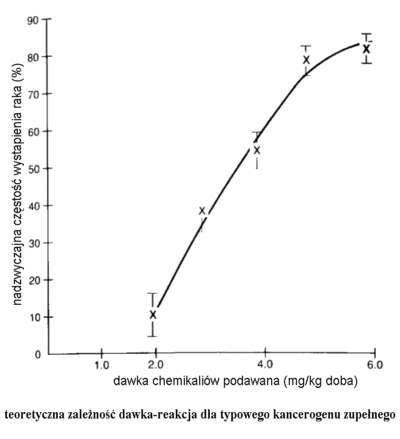
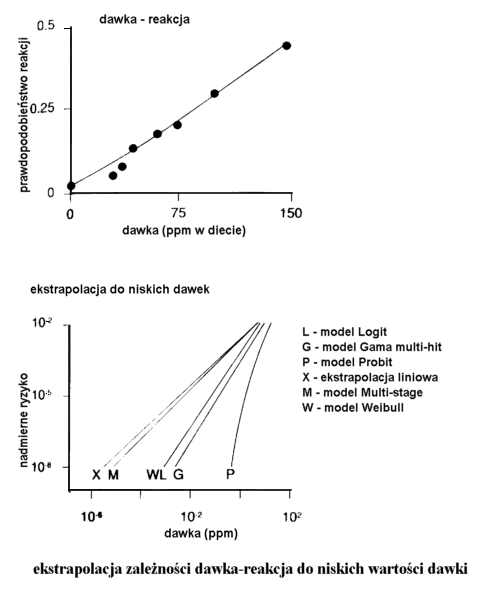
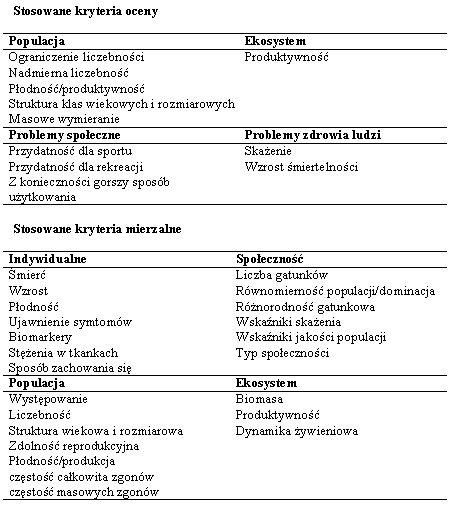
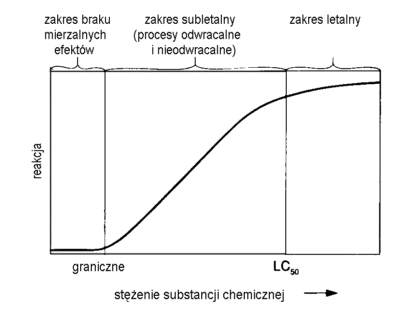
Ekspozycja Kwestia oddziaływania środowiska na zdrowie człowieka ma największe znaczenie dla opinii publicznej. Emisje niebezpiecznych oparów i obecność trujących odpadów w otoczeniu człowieka są przyczyną niepokoju lub nawet paniki. Inżynierowie posługując się niebezpiecznymi chemikaliami muszą pamiętać o społecznej ocenie swoich działań. Mechanizm wpływu substancji trujących na ssaki jest obiektem intensywnych badań w całej historii. W przeciwieństwie do tego oszacowanie uwolnienia chemikaliów i innych składników do biosfery prowadzone były w czasie badania "pomorów ryb" dopiero na początku 20-tego wieku. Dogłębne badania zagrożenia dla gatunków innych niż ludzie uzyskały poparcie dopiero w ostatnich czasach. Problem "ekotoksyczności" zaistniał w latach 60-tych, kiedy Rachel Carson opublikowała dokumentację pt. Silent Spring, która spotkała się z dużą uwagą społeczeństwa. Ruch społeczny wówczas zainicjowany przyczynił się do zrozumienia potrzeby ochrony i dbałości o liczne dzikie (tzn. nieudomowione) gatunki, które są uczestnikami złożonych ekosystemów. Zainteresowanie społeczne od tego czasu jest motorem rozwoju nauki zwanej ekotoksykologią. Od wielu lat prowadzone są intensywne studia nad oddziaływaniem trucizn w środowisku pracy. Od niedawna niemniej wytężone wysiłki podejmują toksykolodzy w celu przedstwienia wpływu na zdrowie małych dawek toksyn obecnych w środowisku stałego pobytu ludzi. Niepokojące rezultaty analizy zagrożeń ze strony trujących składników odpadów i emisji przemysłowych przyczyniły się do zainicjowania intensywnych prac legislacyjnych w celu uregulowania gospodarki niebezpieczymi odpadami oraz ochrony przed toksycznymi emisjami. Wynika to z opinii, że ograniczenie zagrożenia ze strony niebezpiecznych odpadów ma podstawowe znaczenie dla ochrony zdrowia społeczeństwa. Jest elementem najwcześniej podjętej profilaktyki zdrowotnej. Ochrona środowiska życiowego społeczeństwa przed truciznami jest znacznie bardziej efektywną profilaktyką niż wczesne wykrywanie schorzeń i ich leczenie. Utrata sił witalnych społeczności wskutek szkodliwych oddziaływań ekotoksyn może też wynikać z obciążeń psychicznych spowodowanych brakiem wiarygodnej oceny sytuacji. Dlatego najbardziej ogólne przedstawienie aparatu pojęciowego toksykologii jest potrzebne dla zrozumienia opinii specjalistów wydawanych przy okazji ocen efektywności gospodarki odpadami, zagospodarowania skażonych terenów, a nawet ocen ryzyka dla zdrowia związanego z konsumpcją żywności i przyjmowaniem leków. O czym traktuje toksykologia? Toksykologia zajmuje się rozpoznaniem szkodliwych oddziaływań na organizmy żywe powodowanych przez kontakt z substancjami chemicznymi. Toksyny roślinne i jady zwierzęce były znane i badane od wieków. Jednak rozwój toksykologii w postaci odrębnej dyscypliny naukowej datuje się od początku XX wieku. Ukonstytuowanie się tej nowej dziedziny oparte było o zdobycze wielu nauk podstawowych, jak fizjologia, farmacja, biochemia, biologia molekularna i epidemiologia. Będąc konglomeratem zdobyczy wielu dziedzin nauk biologicznych, toksykologia nie jest nauką w rodzaju fizyki czy chemii. Porusza się bowiem w polu nierozpoznanego. W szczególności w kwestii rzeczywistych mechanizmów groźnych oddziaływań chemikaliów na systemy komórkowe jest jeszcze dużo "czystych kart". W opinii społecznej toksykologia ma jednoznacznie negatywne skojarzenia. Fundamentalne znaczenie badań patologów, którzy "post mortem"oceniają wpływ na przyczyny "zejścia" obecności trucizn w organizmie, rzuca cień na dokonania biochemików, biorących na siebie coraz ważniejszą część badań toksykologicznych. Trzeba zrozumieć konieczność prowadzenia badań zarówno biochemicznych, jak i fizjopatologicznych, gdyż prawdziwość wyników osiągniętych jedną tylko techniką jest co najmniej wątpliwa. Budowa skomplikowanych modeli ekotoksykologicznych wymaga posługiwania się niezbitymi dowodami prawdziwości danych toksykologicznych, które są podstawą prognozowania. Jakie są ograniczenia zastosowań toksykologii? Mechanizmy reakcji odpowiedzialnych za skutki zatruć są jeszcze mało zbadane. Dlatego stwierdzenia toksykologów zazwyczaj oparte są na obserwacjach objawów, a badania zatruć rzadko prowadzi się na ludziach. Z oczywistych powodów toksykologia opiera się głównie na doświadczeniach ze zwierzętami. Przenoszenie wniosków z badań laboratoryjnych na funkcjonowanie organizmu ludzkiego związane jest z dużą dozą niepewności. Brak precyzji w przewidywaniach przebiegu zatruć w jednym organizmie (np. u człowieka) na podstawie informacji dotyczących innych gatunków (np. myszy) jest jeszcze większy, jeśli chcemy wnioskować o wpływie niskich dawek trucizn (najczęściej zagrażających ludzkim populacjom) z doświadczeń przy użyciu wysokich dawek podawanych zwierzętom. Większość badań na zwierzętach prowadzona jest w procedurach przyspieszonych, a wzmocnienie efektu zatrucia uzyskuje się przez podawanie dawek znacznie większych niż spotykane w warunkach naturalnych. Następnie stosuje się metodę ekstrapolacji wyników do minimalnych dawek, rzadko tak małych, że odzwierciedlają rzeczywisty poziom zagrożenia. Dlatego w zależności od matematycznej metody ekstrapolacji oceny zagrożenia mogą różnić się o rząd wielkości. Niedoskonałości metod analizy skali skażenia i tempa przemieszczania się zanieczyszczeń w środowisku są więc maskowane przez niepewność oszacowania toksyczności danego związku chemicznego. Czy dane toksykologiczne mają znaczenie dla ekotoksykologii? Kiedy już uświadomiliśmy sobie trudności w uzyskaniu precyzyjnych danych toksykologicznych możemy pochopnie wnioskować, że wyniki badań toksykologicznych niewiele mówią o problemach ekotoksykologii. Warto więc podkreślić, że bazy danych toksykologicznych podają dla wielu chemikaliów wartości wystarczająco dokładne aby oceny zagrożeń związanych z obecnością skażeń w środowisku były miarodajne i ważne epidemiologicznie. Kiedy dane dla określonej substancji nie są bezpośrednio dostępne, można posłużyć się ogólnie akceptowanymi metodami przybliżonych ocen, które również mogą być podstawą do opracowania skutecznej strategii ochrony zdrowia ludzi. Ocena oddziaływania działalności przemysłowej na środowisko, instrukcje posługiwania się niebezpiecznymi substancjami, procedury reagowania na awarie z udziałem chemikaliów, są elementami tej strategii wywodzącymi się z dokonań ekotoksykologii. Ekotoksykologia jest względnie młodą nauką, która posługuje się zasadami toksykologii w badaniach systemów naturalnych w celu oceny możliwości wpływu uwalniania trujących chemikaliów na ich stan. O ile zadaniem tradycyjnej toksykologii ssaków jest wpływ ekspozycji na chemikalia w stosunku do poszczególnych gatunków, głównie ludzi, to ekotoksykologia rozpatruje taki wpływ na grupy w populacjach żyjących w środowisku naturalnym. Innymi słowami, jeśli chemikalia zabiją jakiś procent osobników w populacji, to w przypadku ludzi jest uznawane za katastrofę. Natomiast w przypadku takiego wpływu na ekosystem będzie to zdarzenie o niewielkim znaczeniu ekologicznym w porównaniu do działania chemikaliów, które wprawdzie nie są przyczyną śmierci osobników, za to obniżają głównie produktywność albo ograniczają transfer energii. Działanie to będzie wpływać na funkcjonowanie systemu bezpośrednio, a jego wpływ na strukturę systemu będzie pośredni. Dlatego ważne jest zrozumienie nie tylko bezpośredniego wpływu chemikaliów na organizm, ale również jak działają one na środowisko życia organizmu (np. fizyczna zmiana habitatu wskutek wylewu chemikaliów; utrata źródeł pożywienia; degradacja biologiczna i chemiczna). Jako przykład może posłużyć przypadkowy rozlew ropy, który spowoduje rozmaite efekty. W tym: zmniejszenie fotosyntezy wskutek mniejszej penetracji światła, śmierć organizmów wodnych po zatruciu lekkimi węglowodorami aromatycznymi, wreszcie wniknięcie ciężkich węglowodorów do łańcucha pokarmowego w wyniku akumulacji w tkankach. Co w ekotoksykologii jest najważniejsze dla inżyniera? Inżynierowie nie mogą i nie powinni prowadzić badań toksykologicznych. Doświadczenie i wykształcenie inżynierskie nie upoważnia do rozważań w tej dziedzinie. Jednak ogólne rozeznanie w sposobie rozumowania toksykologa w czasie podejmowania decyzji powinno dopomóc w porozumieniu między fachowcami z dwóch dyscyplin, które dzielą odpowiedzialność za rozwiązania inżynierskie stosowane w działaniach ochronnych. |
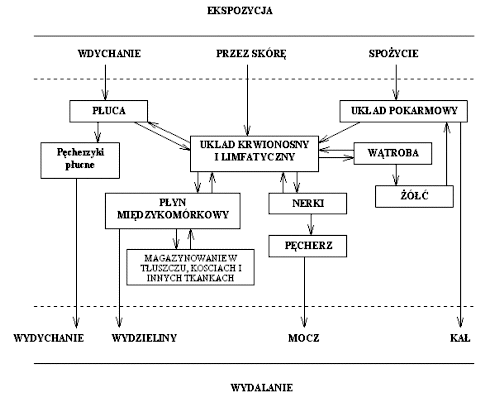
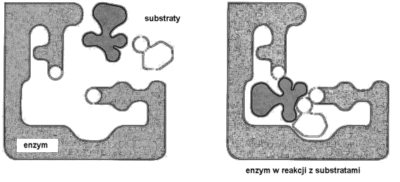
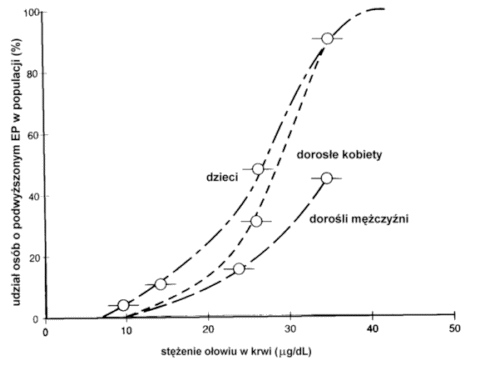
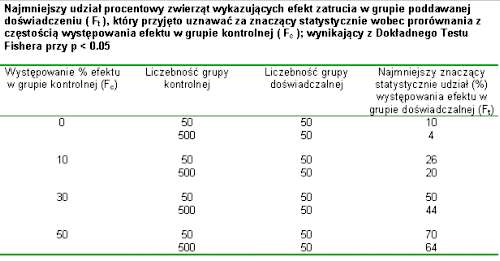
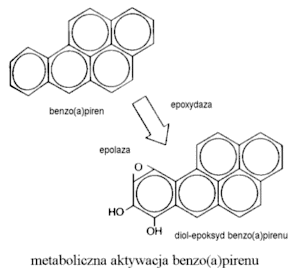
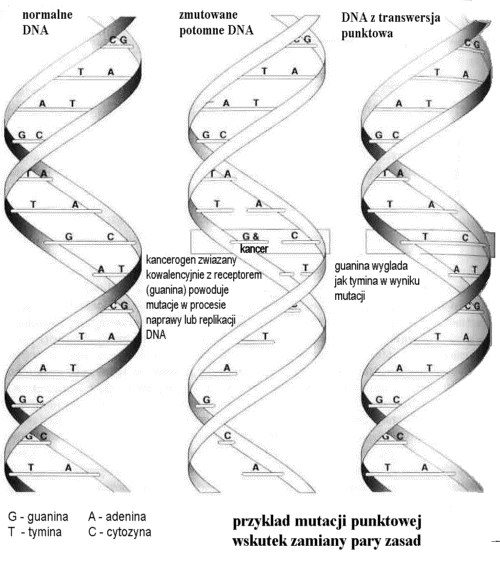
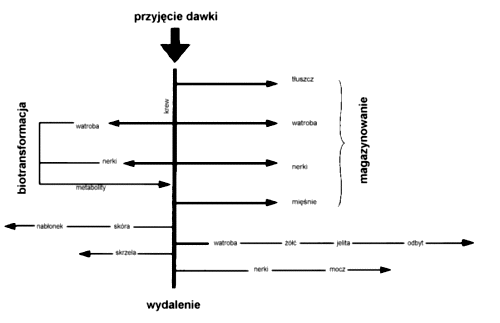
EkspozycjaOd chwili umieszczenia zanieczyszczenia w środowisku jego trujące składniki odbywają wieloetapową drogę do organizmu człowieka. Etap wchłaniania trucizny do organizmu toksykolodzy nazywają drogą wchłaniania (exposure route). Wyróżniają trzy drogi wchłaniania skażeń ze środowiska do organizmu: wdychanie (przez układ oddechowy), spożycie (przez układ pokarmowy) i kontakt ze skórą (przez tkanki skórne). Większość trujących substancji nie powoduje uszkodzeń w miejscu wniknięcia do organizmu. Zaistnienie kontaktu jest natomiast początkiem zawiłej drogi procesów fizjologicznych (metabolicznych) w organizmie człowieka: absorpcji, rozprowadzenia, magazynowania i eliminacji substancji. Żeby wywołać objawy zatrucia czynnik chemiczny lub produkt jego metabolizmu musi wniknąć do miejsca w docelowym organie podatnego na jego działanie. Równocześnie stężenie toksyny musi być dostatecznie duże i pojawić się tam w określonym czasie. Organ docelowy to punkt anatomicznej preferencji dla pojawienia się objawów zatrucia przez daną substancję. Rysunek przedstawia graficznie schemat przenoszenia trucizny po jej wchłonięciu. |