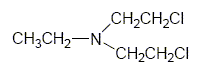iperyty
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
charakterystyka ogólna Iperyty są oleistymi cieczami o słabym, słodkawym, roślinnym zapachu. W wodzie słabo rozpuszczają się. Są dobrze rozpuszczalne w tłuszczach i rozpuszczalnikach organicznych. Destylują z parą wodną, zapalają się w kontakcie z płomieniem lub po ogrzaniu do temperatury zapłonu. Ogrzane do temperatury rozkładu emitują silnie toksyczne opary tlenków siarki (SOx), chlorowodoru i innych związków chloru. Istnieją dowody na rakotwórcze działanie iperytów na ludzi. W licznych publikacjach wykazano wzrost śmiertelności na nowotwory układu oddechowego wśród osób narażonych na działanie iperytu siarkowego. Śmiertelność jest większa w grupie osób narażonych na długotrwałe działanie iperytu w miejscu pracy niż w grupie narażonej na działanie krótkotrwałe. Najwcześniejsze zastosowanie iperytu polegało na użyciu w badaniach biologicznych w charakterze wzorca substancji alkilującej. Badano iperyt w zastosowaniu w formie czynnika przeciwnowotworowego, co nie zakończyło się upowszechnieniem tego zastosowania w praktyce klinicznej. Zastosowanie iperytu w formie gazu bojowego miało duże znaczenie w czasie I wojny światowej. [ATSDR 1998] Iperyty nie występują w przyrodzie w jakiejkolwiek ilości, więc nie można określić ich naturalnego poziomu w ziemi, powietrzu i w wodzie. Aktualnie zapasy iperytów w arsenałach są niszczone poprzez spalenie lub neutralizację chemiczną. Po wylaniu na ziemię iperyt zanieczyszczenie pozostaje co najmniej przez dobę, a okres ten może znacznie się wydłużyć. Czas konieczny do rozkładu iperytu w glebie zależy od temperatury otoczenia i intensywności ruchu powietrza nad ziemią. Kiedy pogoda jest ciepła i wietrzna zanieczyszczenie iperytem zanika szybciej. Iperyt może ulecieć z gleby w formie oparów lub przekształcić się w inne substancje pod wpływem wilgoci. Jeśli iperyt zostanie zakopany głęboko w ziemi, może tam pozostawać przez wiele lat. Iperyt nie może penetrować w glebie do wód gruntowych. W kontakcie z wodą ulega rozpuszczeniu, jeśli woda jest w ruchu. W stojącej wodzie rozpuszcza się wolno. Po rozpuszczeniu w wodzie natychmiast ulega przemianie w inne substancje. W temperaturze 40 °C ilość rozpuszczonego iperytu w wodzie zmniejsza się o połowę w czasie 2 minut. Kiedy znaczne ilości iperytu zanieczyszczą wodę, to proces oczyszczenia wody będzie zachodził przez bardzo długi czas. Opary iperytu w powietrzu reagują z utworzeniem innych substancji. W temperaturze 25 °C ilość iperytu w powietrzu zmniejsza się o połowę w czasie 2 dni. Ponieważ iperyt w środowisku przekształca się w inne substancje, nie jest gromadzony w roślinach anie w zwierzętach. Zagrożenie związane z iperytem dotyczy osób przebywających w okolicy składowisk niebezpiecznych odpadów, gdzie porzucony został iperyt. Również możliwe jest użycie iperytu przez terrorystów. Pracownicy towarzyszący transportowi lub zaangażowani przy liwkwidacji iperytu mogą być narażeni na iperyt w przypadku nieumyślnego rozlewu lub emisji oparów. Dzieci tych osób mogą być narażone na działanie iperytu, jeśli pracownik go przeniesie do mieszkania w postaci zanieczyszczeń na ubraniu lub skórze. Iperyt szybko przenika przez odzież. Ponieważ iperyt szybko reaguje z wodą, to nie należy obawiać się spożycia z wodą. Z tego powodu ocenia się, że prawdopodobieństwo narażenia ludności na kontakt z iperytem pod postacią zanieczyszczonej wody podczas czynności picia, gotowania, kąpieli, czy mycia, jest bardzo małe. [ATSDR 2003] Do iperytów tu opisanych zalicza się iperyt siarkowy i destylowany (H i HD), i iperyty azotowe (HN-1, HN-2, i HN-3). Z uwagi na ich własności fizykochemiczne należą one do trwałych zanieczyszczeń środowiska w klimacie chłodnym. W warunkach cieplejszych szybkość ulatniania się wzrasta [Zajtchuk], chociaż trwałość w ciepłym środowisku silnie wzmacniano poprzez dodatki zagęszczające.[NATO]
Iperyt siarkowy zsyntgezowano w 1822 roku. Był używany od lat 1880tych jako pestycyd oraz do leczenia wczesnych form raka. Jako gaz bojowy po raz pierwszy użyty był pod Ypres przez Niemców przeciw Brytyjczykom w czasie I wojny światowej w 1917 roku. Z tego powodu powszechnie używana jest nazwa iperyt na ten gaz bojowy. Iperyt siarkowy wchodzi w skład gazów parzących grupy H, do której należą:
Iperyt destylowany HD jest oleistą cieczą w kolorze jasno zółtym do ciemno brązowego o zapachu oleju z ziaren musztardy. [Abercrombie] Iperyt lewinsteina H jest tym rodzajem iperytu, który był używany w czasie I wojny światowej. Własności obu tych rodzajów iperytu są w zasadzie identyczne. [USACHPPM]
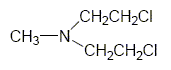
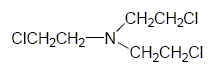
Wzór strukturalny:
Czysty iperyt azotowy (HN-1) jest bezbarwną cieczą o słabym zapachu ryb lub mydła. [DoD 2000]
Czysty iperyt azotowy (HN-2) jest bezbarwną cieczą o słabym zapachu ryb lub mydła. [DoD 2000]
Czysty iperyt azotowy (HN-3) jest bezbarwną i bezwonną cieczą . [Abercrombie] Wśród iperytów azotowych jest najbardziej stabilny. [Kirner]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Iperyty są chemikaliami wywołującymi
oparzenia skóry. Jednak ich toksyczne działanie nie ogranicza się do
tkanki skórnej i jest procesem wieloaspektowym. Iperyty siarkowe są
czynnikami cytotoksycznymi alkilującymi, które wytwarzane były na skalę
przemysłową w celu użycia w charakterze broni chemicznej. Powodują
uszkodzenie narządu wzroku, tkanki skórnej i układu oddechowego, co
wywiera skutek taktyczny w postaci natychmiastowego wyłączenia z akcji,
ograniczenia zdolności bojowej i demoralizacji. W zależności od
narażenia obrażenia mogą być lokalne lub układowe. Iperyty azotowe
również były produkowane jako trucizny wojskowe. Niemniej HN-1 został
pierwotnie użyty jako farmaceutyk. HN-2 jako mechlorethamine znalazł
zastosowanie do terapii przeciwnowotworowej. W tym zastosowaniu, jako
środki alkilujące dla terapii przeciwrakowej, znalazły się też pochodne
jak melphalan, chlorambucil i cyclophosphamide. [Somani, 1992] Iperyt w środowisku zachowuje swoje własnoaści toksyczne przez długi czas. Rozpylony nad ziemią może utrzymywać się przez ok. 2 tygodnie. Rozlany na grunt stwarza niebezpieczeństwo przez 3 lata. [DoD 1974] Trwałość iperytu w środowisku wynika z utworzenia się na jego powierzchni produktów degradacji o budowie oligomerycznej, które są odporne na hydrolizę i wietrzenie. [Rosenblatt 1995] Równocześnie własności iperytu takie jak log Kow = 1.37 i Koc = 133 wskazują na silne powinowactwo do organicznych składników gruntu, co ogranicza jego zdolność do migracji z wodą gruntową. Jego indeks odcieku wynosi 7,2 , co oznacza, że do zmniejszenia stężenia iperytu w glebie o 10% początkowej wartości trzeba przepływu 7,2 litrów wody przez 1 kg gruntu. [MacNaughton 1994] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Z powodu dużej lipofilności toksyczne dawki iperytu są wchłaniane do tkanki nabłonkowej. [Papirmeister 1991] Wchłanianie przez skórę zależy od grubości naskórka i obecności wilgoci. Jest szybsze u podstawy mieszków włosowych, gdzie tkanka nabłonka jest cieńsza niż na całej powierzchni skóry. [Papirmeister 1991] Około 20% dawki ulokowanej na skórze jest szybko wchłaniane, a 12-50% dawki pozostaje w miejscu kontaktu. [Somani 1989] Około 88% wchodzi do krwioobiegu. Szybkość penetracji wynosi 1-4 mg/cm2/min w temp. otoczenia. [Renshaw 1947] Z udziałem ochotników płci męskiej zrealizowano badania wpływu czasu ekspozycji, temperatury i wilgotności na wnikanie par HN-1 i HN-3 do skóry przedramienia. [NDRC 1945] Wyniki tych prac wykazały podobieństwo wpływu temperatury i wilgotności do obserwowanych w przypadku iperyt siarkowego, np. zwiększenie absorpcji ze wzrostem temperatury i wilgotności. Wchłanianie HN-1 i HN-3 okazało się liniowo rosnące z upływem czasu (5 do 20 min dla HN-1 i 30-60 min dla HN-3). W temp. 22oC (72oF) i 50-52% wilgotności względnej dla HN-1 wskaźnik penetracji wyniósł 2,8 mg/cm2/min. Dla HN-3 wynosi 0,18 mg/cm2/min w temp. 22oC (72oF) i 45-48% wilgotności względnej. W temp. 32oC (87oF) i 47-49% wilgotności względnej dla HN-1 wskaźnik penetracji wzrósł do 5,2 mg/cm2/min, a dla HN-3 wzrósł do 0,3 mg/cm2/min. Kilka badań z wykorzystaniem znakowanego iperytu siarkowego wykazało, że iperyt i jego metabolity znajdowane są w wielu miejscach ciała po ekspozycji poprzez skórę lub po podaniu dożylnym. Najwyższe poziomy radioaktywności wykryto w nerkach, płucach i wątrobie królików po podaniu dożylnym [Boursnell 1946]. W 15 min po skórnej ekspozycji szczurów radioaktywność pochodzącą z iperytu stwierdzono we wszystkich badanych tkankach, z wyjątkiem oczu [Young 1944]. Stwierdzono równomierne napromieniowanie myszy po ekspozycji skórnej lub po podaniu iperytu dożylnym. Jednak największą radioaktywność występuje w rejonie nosa, nerek, wątroby i w jelitach. [Clemedson 1963] Większość iperytu wprowadzanego do krwi wiąże się z hemoglobliną i w pewnym stopniu z glutationem. [Hambrook 1993] Wykazano, że w 5 min po narażeniu na opary iperyt koncentruje się w rogówce, a w mniejszym stopniu w tęczówce, soczewce i spojówce. [Axelrod 1947] Badano biotransformację znakowanego iperytu po podaniu dożylnym lub dootrzewnowym u szczurów. Po dożylnym wstrzyknięciu głównym metabolitem był koniugat glutationu z bischloroetylsiarką (45% całkowitej radioaktywności), a w mniejszym udziale koniugat sulfonu (7%), oraz tiodiglykol i jego koniugaty (14,4%). [Davison 1961] U szczurów po dootrzewnowym wstrzyknięciu iperytu głównym metabolitem jest bis-(b-chloroetylo)sulfon cysteiny w moczu. [Roberts 1963] Najważniejszym kierunkiem detoksykacji jest hydroliza do tiodiglikolu i reakcja z glutationem [Papirmeister 1991] Potwierdzają to dane z badań u ludzi, gdzie wykazno obecność tiodiglikolu w moczu po 2 tygodniach i później od narażenia na iperyt. [Wils 1987] Wydalanie z moczem jest prawdopodobnie główną drogą eliminacji.
Mechanizm działania iperytu jest złożony i wielopłaszczyznowy. [Papirmeister 1991] [Hurst 2008] Dotychczas nie zostały zidentyfokowane wszystkie aspekty toksycznych działań iperytu. Pierwszym dostrzegalnym działaniem jest uszkodzenie powiązań naskórka z tkanką podskórną, co wywołuje powstawanie pęcherzy pomiędzy naskórkiem i skórą właściwą. Zbadano zarówno bezpośrednie, natychmiastowe uszkodzenia błony komórkowej, jak też opóźnione skutki ekspozycji skórnej na iperyt, takie jak reakcje zapalne, uszkodzenia DNA, wysięk płynów komórkowych. [Somani 1989] Wiele toksycznych skutków narażenia na iperyt można przypisać do stresu oksydacyjnego. Wśród najlepiej zbadanych mechanizmów toksyczności iperytu są: blokada grup tiolowych i wynikające stąd zaburzenia wewnątrzkomórkowej równowagi wapnia, prowadzące do śmierci komórki, alkilacja DNA i innych makrocząsteczek komórkowych, peroksydacja lipidów wynikająca z ubytku glutationu, oraz wywoływanie reakcji zapalnej. Ogólny mechanizm toksyczności iperytu prawdopodobnie zawiera wszystkie wymienione procesy. Kluczowym elementem toksyczności iperytu jest tworzenie jonów sulfoniowych i powstawanie episulfoniowych związków pośrednich, które mogą reagować z makrocząsteczkami zawierającymi grupy tiolowe. Mogą powstawać uszkodzenia Ca2+ translokazy (Ca2+- stymulowane, Mg2+-zależne ATP-azy), zawierających grupy tiolowe i są konieczne do utrzymania homeostazy komórkowej Ca2+ i mikrofilamentowych białek. Wynikający z tego wzrost wewnątrzkomórkowego stężenia wapnia ostatecznie powoduje zaburzenie integralności komórki i indukcję apoptozy. Stres oksydacyjny wynikający z toksyczności iperytu został opisany. [Smith 2008] Przedstawiono hipotezę toksyczności iperytu, w której centralne znaczenie ma alkilacja DNA i polimerazy poli(ADP-rybozy) (PARP). [Papirmeister 1991]. W tym mechanizmie, DNA jest początkowym celem iperytu. Alkilowane puryny DNA są enzymatycznie depurynowane, co tworzy miejsca bezpurynowe, które są przecinane przez endonukleazy apurynowe, a to powoduje przerwanie łańcucha DNA. Nagromadzenie pęknięć DNA prowadzi do aktywacji enzymu chromosomalnego PARP, który wykorzystuje NAD+ powoduje poważne obniżenie komórkowego NAD+. Ubytek NAD+ powoduje hamowanie glikolizy i stymulację kofaktora monofosforanu heksozy i fosforanu dinukleotydu nikotynamidoadeninowego (NADP+)-zależnego, ostatecznie prowadząc do indukcji i uwalniania proteaz i do kolejnych zmian komórkowych. Cytotoksyczność wywołana przez iperyt jest zależna od dawki. [Papirmeister 1991] DNA wydaje się być bardziej wrażliwe na alkilowanie przez iperyt niż inne składniki komórek. Niskie dawki iperytu mają charakter genotoksyczny i hamują mitozę. Utrata reprodukcji komórkowej może być spowodowane dwufunkcyjnym alkilowaniem, co uniemożliwia normalną replikację DNA. Panuje opinia, że w przypadku małych dawek iperytu jednofunkcyjne uszkodzenia DNA mogą być odpowiedzialne za działanie mutagenne i prawdopodobnie rakotwórcze. Wywołana przez iperyt peroksydacja lipidów jest funkcją ubytku glutationu (GSH). Według tego mechanizmu, niedostatek GSH powoduje nagromadzenie reaktywnych form tlenu przez procesy zależne od nadtlenku wodoru. [Miccadei 1988] Rodniki tlenu reagują z fosfolipidami błony komórkowej z utworzeniem nadtlenków lipidów, które zmieniają strukturę błony, powodując jej przerwanie. Najnowsze prace koncentrują się na identyfikacji biomarkerów ekspozycji na iperyt i urazów stąd wynikających [Buxton 2000, 2001] [Danne 2000]. Ostatnio badano rolę metaloproteinaz i degradacji kolagenu [Gerecke 2005], czynniki aktywujące płytki krwi [Clark 2005, 2006] oraz interakcje z procesami w cytochromie P450 [Brimfield 2005, 2006] [Mancheco 2006] w relacji do mechanizmu działania iperytu. Kluczowym elementem toksyczności iperytu azotowego jest analogicznie do działania iperytu siarkowego tworzenie cyklicznych kationów oniowych. Odbywa się to w obecności rozpuszczalników polarnych, takich jak woda [Somani 1992]. Jon imoniowy może reagować z nukleofilami, takimi jak azot w zasadach kwasów nukleinowych i siarkowodorowymi grupami białek i peptydów. Dokładny mechanizm działania iperytu azotowego nie jest zbadany, ale zaproponowano: alkilowanie DNA/RNA i wynikające z alkilacji skutki, wpływ na glutation, uszkodzenia błony komórkowej (sieciowanie białek, wpływ na transport jonów) i wpływ na równowagę cytoplazmatyczną (uwalnianie enzymów lizosomalnych). Możliwe mechanizmy działania iperytu azotowego zostały poddane przeglądowi. [Gray 1989] U myszy, którym podawano dootrzewnowo HN-2 zaobserwowano zmiany w płucach wskazujące na stres oksydacyjny i zaburzenia procesów detoksykacji, co potwierdza działanie wyżej wymienionych mechanizmów. [Elsayed 2006] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Toksyczne działanie iperytu siarkowego na ludzi i zwierzęta były wielokrotnie przedmiotem badań. [ATSDR 2003] [Sidell 1992] [Somani 1992] [Watson 1992] [IOM 1993] [NRC 2003] [Romano 2008] Iperyty działają na skórę, układ oddechowy i oczy. Ostre skutki zatruć obejmują obrzęk, owrzodzenie i martwicę tkanki skórnej. Toksyczność układowa może mieć miejsce także i charakteryzuje się nudnościami i wymiotami, gorączką i złym samopoczuciem. Istnieją dowody na toksyczność systemową (przewodu pokarmowego) po ekspozycji tylko przez skórę. [Dacre 1996] Opóźnione skutki zatruć obejmują zapalenie spojówek i ślepotę po ekspozycji oczu ma iperyt i przewlekłe zapalenie oskrzeli po ekspozycji przez drogi oddechowe. Porażone tkanki mogą wykazywać zwiększoną podatnośc na infekcje wtórne i na powstanie raka skóry i dróg oddechowych. Toksyczność iperytu zależy od temperatury i wilgotności otoczenia. W ciepłym i wilgotnym środowisku niższe stężenia iperytu powodują efekty toksyczne. Działanie iperytu na części ciała o większej wilgotności (np. pachy, pachwiny, oczy) jest silniejsze. Niewiele wiadomo o toksycznym działaniu długotrwałego narażenia na niskie poziomy iperytu, które nie powodują ostrych zatruć. Dostępne dane wskazują, że lokalizacja oraz stopień uszkodzenia wynikające z narażenia na iperyt są zależne od stężenia i są funkcją bardzo reaktywnego charakteru iperytu [Papirmeister 1991] Oczy są uważane za najbardziej wrażliwe i szybko reagujące na porażenie. [Reed 1918, 1920] [Anderson 1942] Dla słabych ekspozycji na iperyt uszkodzenia są przypuszczalnie ograniczone do górnych dróg oddechowych [Eisenmengera 1991] i oczu [Reed 1918, 1920] [Guild 1941] [Anderson 1942] W pracy z ochotnikami wykazano [Anderson 1942], że wartości Ct 60-75 mg-min/m3 powodują zapalenie spojówek, światłowstręt, podrażnienie oczu, a przy wartości Ct 75-90 mg-min/m3 obserwuje się znaczny udział poważniejszych uszkodzeń oka, wymagający kilku tygodni leczenia. Przy wyższych stężeniach należy należy oczekiwać uszkodzeń płuc. [Eisenmengera 1991] Niezależnie od tkanki docelowej, istnieje okres opóźnienia między ekspozycją i ujawnieniem zatrucia. Oczy i drogi oddechowe wykazują najkrótszy okres utajenia, z objawami w ciągu kilku godzin w zależności od poziomu ekspozycji. Oprócz ostrych działań toksycznych na oczy, skórę i drogi oddechowe, zostały udokumentowane u osób narażonych na działanie iperytu ostre i długotrwałe efekty neuropsychiatryczne (np. depresja, lęki, neurastenia, bezsenność, zespół stresu pourazowego). [Romano 2008] Wiele z tych przypadków dotyczy osób narażonych w środowisku pracy (np. pracowników zakładu wytwarzającego amunicję) i nie zawsze są wynikiem wysokiego poziomu narażenia, które powodowałoby poważnych objawy zatrucia. Długotrwałe schorzenia, takie jak przewlekłe zapalenie oskrzeli, było związane z narażeniem zawodowym, które obejmowało epizody ostrej toksyczności. Także opóźnione lub nawracające zapalenie rogówki pojawiały się po 8-40 lat od narażenia na opary iperytu. Znane są również przypadki immunosupresji wywołanej iperytem, co powoduje większą podatność na infekcje. Dane dotyczące śmiertelności ostrych zatruć zwierząt zestawiono w tabeli. Na podstawie danych dla zwierząt widać, że międzygatunkowe różnice reakcji na śmiertelne dawki oparów iperytu są mniejsze niż rząd wielkości. Tabela
Badano wpływ na stan układu pokarmowego iperytu podawanego szczurom. [Sasser 1989] Stwierdzono nowotwór nabłonka (acanthosis i hyperplasia) w przedżołądku przy dawce najwyższej ale nie śmiertelnej. Badania na zwierzętach wykazały, że iperyt może wywoływać uszkodzenia rozwojowe i reprodukcyjne. [NRC 1999, 2003] W wyniku ostrej ekspozycji ogólnoustrojowej iperyt ma wpływ na zdolności rozrodcze, w tym zahamowanie spermatogenezy. Wady płodu obserwowano w badaniach na szczurach, którym podawano iperyt w czasie ciąży, ale tylko w przypadku kiedy dawki były toksyczne dla matki. Genotoksyczność iperytu jest dobrze udokumentowana. Wiadomo, że iperyt powoduje krzyżowe wiązania DNA, mutacje wynikające z błedów replikacji i napraw, zerwania i zniekształcenie chromosomów. Choroby w związku z narażeniem zawodowym zostały powiązane ze zwiększeniem częstości mutacji komórek somatycznych, wymiany chromatyd siostrzanych i zaburzeń chromosomowych. Rakotwórczość iperytu dla zwierząt została zwerfikowana w przeglądach. [IARC 1975] [Watson 1989] [IOM 1993] [NRC 1999] [USACHPPM 2000] Wzrost częstości występowania nowotworów płuc obserwowano w szczepie myszy A po dożylnym podawaniu (cztery dawki dziennie przez 2 dni) iperytu siarkowego [Heston 1950] i pojawinie się guzów u myszy w miejscu wstrzyknięcia podskórnego w czasie 6 tygodni. [Heston 1953] W badaniach populacji irańskich weteranów wojskowych, narażonych na poziomie wystarczającym do ujawnienia silnego zatruciana iperytem siarkowym w warunkach bojowych podczas konfliktu iracko-irańskiego, wykazano potencjalne zwiększenie częstości występowania przewlekłej białaczki szpikowej (chronic myelocytic leukemia CML). W wielu wcześniejszych badaniach weteranów I wojny światowej, którzy byli narażeni na iperyt, białaczka nie została zidentyfikowana. Jednak nie wiadowmo czy badanie na CML kiedykolwiek miały miejsce w tych przypadkach. Dwa przypadki CML zaobserwowano u japońskich pracowników narażonych na działanie iperytu [Shakil 1993], jednak częstość występowania CML w całej populacji pracowników i ludności w grupie kontrolnej nie zostały przedstawione. Badania na zwierzętach dostarczają dowody rakotwórczości iperytu siarkowego, chociaż wyniki niektórych badań mogą budzić wątpliwości przez niewystarczający czas ekspozycji i występowanie obrażeń wynikających z zamknięcia w klatkach. Informacje dotyczące toksyczności iperytu azotowego nie są tak obszerne. Podobnie jak w przypadku iperytu siarkowego, narażenie na iperyt azotowy może powodować powstawanie pęcherzy na skórze, jak również porażenie dróg oddechowych i uszkodzenie oka. Wyniki z badań ochotników [NDRC 1944] szeregują względną moc iperytów HN-3> HN-1> HN-2 pod względem efektu parzącego, chociaż różnice były niewielkie. Podobnie jak z iperytem siarkowym, skórne efekty były wzmocnione przez wilgoć (od pocenie się), a. uszkodzenia oka (podrażnienie uniemożliwiające działania wojskowe) wykryto w ekspozycji na znacznie niższe stężenia niż te powodujące uszkodzenie skóry. Wszystkie toksyczne działania iperytów azotowych cechuje okres opóźnienia rzędu kilku godzin dla reakcji oczu i kilku dni do pojawienia się pęcherzy na skórze. Iperyty azotowe to znane czynniki alkilujące o określonej mutagenności, jednak nie dysponujemy ocenami ich rakotwórczości dla zwierząt i ludzi. Wykazano teratogenne działanie iperytu azotowego i jego chlorowodorku w przypadku myszy i szczurów. Podawanie dootrzewnowe chlorowodorku HN-2 u myszy spowodowało poważne efekty teratogenne. [Danforth 1954] [Haskin 1948] [Murphy 1958] Iperyty azotowe posiadają dwufunkcyjne działanie alkilujące, które przyczyniają się do powstania raka (przede wszystkim nowotwory płuc i chłoniaki) u myszy po podaniu podskórnym, dootrzewnowym i dożylnym, jak również przez skórę. [IARC 1987a] Dozylne podanie iperytu azotowego u szczurów powoduje raka wielu narządów [IARC 1987b] Informacja o działaniu na ludzi ogranicza się do wykazania pojawienia się płaskonabłonkowego raka skóry po terapeutycznym zastosowania iperytu azotowego w leczeniu grzybic, ziarniniaków i łuszczyc. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Różne standardy i wytyczne zostały opracowane dla iperytów. Wartości te mają zastosowanie do oceny narażenia zawodowego, planowania działań interwencyjnych i ratunkowych oraz zapobiegawczych. Poziom graniczny stężenia w powietrzu (airborne exposure limits AELs) i poziom stężenia wynikający z warunków ochrony zdrowia w środowisku (health-based environmental screening levels HBESLs) dla iperytu siarkowego zostały opracowane przez US Army. [USACHPPM 1999, 2000] Wiekszość kryteriów zdrowotnych oparto na ocenie narażenia na opary iperytu oczu i dróg oddechowych, które są najbardziej wrażliwe. Wytyczne dla ostrego zatrucia (AEGLs) iperytem siarkowym zostały opracowane dla potrzeb zastosowań w sytuacjach awaryjnych i planowania w sytuacjach kryzysowych. [NRC 2003] AEGLs stanowią dopuszczalne stężenia progowe dla ogółu społeczeństwa i mają zastosowanie do awaryjnego narażenia przez okres od 10 minut do 8 godzin. Dawka referencyjna (reference doses RfDs) jest wyliczona dla ludzi z oszacowania dawki dobowej, która nie powinna sprowadzić znacznego ryzyka pojawenia się szkodliwych skutków dla zdrowia podczas całego życia. [NRC 1999] Podsumowanie szeregu wytycznych i norm dotyczących iperytu siarkowego jest już dostępne. [ATSDR 2003] Niewiele standardów i wytycznych jest dostępne dla iperytów azotowych. Wartości AEGL do iperytów HN-1, HN-2 i HN-3 zostały opracowane w oparciu na ocenie narażenia na podrażnienia oczu z udziałem ochotników (AEGL-2) i na badaniu śmiertelności gryzoni (AEGL-3). Dane były niewystarczające do wyliczania wartości poziomu AEGL-1. Armia USA opracowała limit dla populacji pracowników (Worker Population Limit WPL) oraz limit dla ludności (General Population Limit GPL) dla iperytu azotowego. [USACHPPM 1996, 2004] Międzynarodowa Agencja Badań nad Rakiem (International Agency for Research on Cancer IARC) sklasyfikowała iperyt siarkowy do Grupy 1 rakotwórcze dla ludzi. [IARC 1987] Również Narodowy Program Toksykologii (National Toxicology Program NTP) wymienia iperyt jako substancję uznana za rakotwórczą dla ludzi. [DHHS 2002]. Te oceny są oparte na danych z badań ludzi i zwierząt. Badania narażenia zawodowego na działanie iperytu siarkowego wskazują podwyższone ryzyko powstania nowotworów dróg oddechowych i skóry w następstwie długotrwałego narażenia na stężenie silnie toksyczne. Ogólnie rzecz biorąc, kilka czynników uważa sie za istotne w odniesieniu do oceny rakotwórczości iperytu siarkowego. Wzrost zachorowań na raka u ludzi jest związany tylko z narażeniami, które spowodowały poważne skutki ostre, jak też z ekspozycją zawodowa polegającą na wielokrotnych narażeniach i powtarzających się uszkodzeniach tej samej tkanki. Ponieważ w zastosowaniach leczniczych iperyt azotowy powoduje zwiększoną częstość występowania przewlekłej białaczki szpikowej, wskazania na CML u osób narażonych na HD wydaje się być istotne dla oceny działania rakotwórczego iperytu siarkowego. Wskaźniki wzrostu wartości jednostki ryzyka dla iperytu zostały zweryfikowane. [ATSDR 2003] Nie są dostępne informacje o ilościowej ocenie ryzyka dla iperytu azotowego jako środka rakotwórczego. [IARC 1987] Uważa się iperyt azotowy za spełniającyc kryteria w Grupie 2A - rakotwórczy na podstawie ograniczonych dowodów u ludzi i wystarczających dowodów u zwierząt. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Leczenie narażenia na iperyt rozpoczyna się od profilaktyki. Wojskowe użycie iperytu wymaga ochrony całego ciała. Znaczny wysiłek włożono w rozwój i ocenę sprzętu i ubrań ochronnych. [Schier 2005] Na ogół są to respiratory oczyszczające powietrze i chemiczna odzież ochronna, tj. materiały nieprzepuszczalne dla par chemikaliów i odzież nasycona chemikaliami absorpcyjnymi i neutralizującymi trucizny. W przypadku narażenia konieczne jest szybkie oczyszczanie. Może obejmować usuwanie zanieczyszczonej odzieży i usunięcie/neutralizację trucizny z powierzchni ciała. Narażenie oczu będzie wymagało szybkiego usunięcia trucizny z powierzchni oczu przez płukanie wodą. Narażenie na opary może wymagać wspomagania oddechowego. Ponieważ nie ma antidotum na zatrucie iperytem, ratownictwo medyczne polega na zapobieganiu, oczyszczaniu i paliatywnym leczeniu objawów. Możliwość stosowania antidotum (np. przeciwutleniacze) została oceniona. [Smith 2008] Aktualnie są opracowywane i oceniane gąbki poliuretanowe zawierające środki do neutralizacji trucizn jako pomocnicze przy odkażaniu/detoksykacji. [Gordon 2006] Metody postępowania medycznego przy zatruciach iperytami (i innymi czynnikami parzącymi) zostały poddane przeglądowi. [Munro 1990] [Keyes 2005] Leczenie narażenia na iperyt azotowy jest podobne i obejmuje zapobieganie ekspozycji. Jeżeli ekspozycja ma miejsce, polega na odkażaniu i na terapii wsparcia. Stosowanie przeciwutleniaczy w leczeniu zatruć iperytem azotowym jest obecnie badane. [Hardej 2006]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Źródła | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Abercrombie, P. L., and Butrow, A.B.,
Selected Physical Properties of Ton Container HD (Mustard) and VX,
ERDEC-TR-450, U.S. Army Edgewood Research, Development, and Engineering
Center, Aberdeen Proving Ground, MD, July 1998, UNCLASSIFIED Report
(ADA350462). Anderson, J.S. 1942. The Effect of Mustard Gas Vapour on Eyes under Indian Hot Weather Conditions. CDRE Report No. 241. Chemical Defense Research Establishment (India). ATSDR, KNOWN TO BE A HUMAN CARCINOGEN: Mustard gas, CAS No. 505-60-2. Agency for Toxic Substances and Disease Registry, 1998, 1 p. ATSDR, TOXICOLOGICAL PROFILE FOR SULFUR MUSTARD. Agency for Toxic Substances and Disease Registry, 2003, 217pp.217 Axelrod, D.J. and J.G. Hamilton. 1947. Radio-autographic studies of the distribution of lewisite and mustard gas in skin and eye tissues. Am. J. Pathol. 23:389-411. Bartlett, P.D., and Swain, C.G., “Kinetics of Hydrolyisis and Displacement Reactions of ß ß’-(Dichlorodiethyl Sulfide (Mustard Gas) and of ß -Chloro- ß’-hyroxidediethyl Sulfide (Mustard Chlorohydrin),” J. Chem. Soc., Vol. 71, 1949. Boursnell, J.C., J.A. Cohen, M. Dixen, et al. 1946. Studies on mustard gas (ßß' -dichlorodiethyl sulphide) and some related compounds. 5. The fate of injected mustard gas (containing radioactive sulphur) in the animal body. Biochem. J. 40:756-764. Bowden, E. (1943). Median detectable concentrations by odor of plant run mustard, plant run Lewisite and pilot plant ethyl nitrogen mustard. ADB 969801, TDMR 615 (April). Brimfield, A.A., Hodgson, E. (2005). Observations on the interaction of sulfur mustard with cytochrome P450. Toxicologist 84(S-1): 159. Brimfield, A.A., Novak, M.J., Mancebo, A.M., Gallagher, B.S., Arroyo, M. (2006). The detection of free radical formation from the interaction of sulfur mustard with NADPHcytochrome P450 reductase. Toxicologist 90: 391. Brookfield, K. J.; Woodward, F. N.; Owens, R. The kinetics of hydrolysis of vesicants. Part II. 2,2′-dichlorodiethylsulphide (H). Sutton Oak Report 576; Military Intelligence Division: Sutton Oak, U.K., Mar 3, 1942. Brooks, M. E. and Parker, G.A., Incineration/Pyrolysis of Several Agents and Related Chemical Materials Contained in Identification Sets, ARCSL-TR-79040, October 1979, UNCLASSIFIED Report (ADB042888). Buckles, M.F., CW Vesicants: Selected Values for the Physical Properties of H, T, and Q (U), Special Report CRLR 542, Chemical Corps Chemical and Radiological Laboratories, Army Chemical Center, MD, May 1956, UNCLASSIFIED Report (AD108272). Buxton, K.L., Babin, M.C., Ricketts, K.M., Gazaway, M.Y., Blank, J.A., Danne, M.M. (2000). Characterization of sulfur mustard-induced proinflammatory mediator response in mouse ears. Toxicologist 54: 213. Buxton, K.L., Danne, M.M., Babin, M.C., Ricketts, K.M., Gazaway, M.Y., Sabourin, C.L., Casillas, R.P., Schlager, J.J. (2001). Gene array analysis of sulfur mustard-induced inflammatory mediator response in mouse ear. Toxicologist 60: 129. Cheicante, R.L., et al., “Investigation for the Determination of Nitrogen Mustard and Related Compounds in Air by Gas Chromatography Using Solid Sorbent Collection and Thermal Desorption,” In Proceedings of the 1998 ERDEC Scientific Conference on Chemical and Biological Defense Research 17-20 November 1998, UNCLASSFIED Paper, ERDEC-SP-004, USA Edgewood Chemical Biological Center, Aberdeen Proving Ground, MD, July 1999, UNCLASSFIED Report (ADA375171). Clark, O.E., Neally, E.W., Leiter, K., Miller, A.L., Nicholson, J.D., Smith, W.J. (2006). Endothelial cell alterations following in vitro exposure to sulfur mustard or platelet activating factor. Toxicologist 90: 391. Clark, O.E., Neally, E.W., Leiter, K.W., Finke, K.I., Miller, A.L., Smith, W.J. (2005). Putative role of platelet activating factor (PAF) analogs in cell cycle aberrations in human endothelial cells in vitro. Toxicologist 84(S-1): 160. Clemedson, C.-J., H. Kristoffersson, B. Sorbo and S. Ullberg. 1963. Whole body autoradiographic studies of the distribution of sulphur 35-labelled mustard gas in mice. Acta Radiol. Ther. 1:314-320. Dacre JC, and Goldman M, “Toxicology and Pharmacology of the Chemical Warfare Agent Sulfur Mustard,” Pharmacol Rev, 48, 1996, pp. 289–326. Danforth, C.H., Center, E. (1954). Nitrogen mustard as a teratogenic agent in the mouse. Proc. Soc. Exp. Biol. Med. 86: 705–7. Danne, M.M., Babin, M.C., Gazaway, M.Y., Ricketts, K.M., Schlager, J.J., Buxton, K.L. (2000). Gene expression array analysis of sulfur mustard-induced proinflammatory mediator response in mouse ears. Toxicologist 54: 213. Davison, C., R.S. Rozman and P.K. Smith. 1961. Metabolism of bis-ßchloroethyl sulfide (sulfur mustard gas). Biochem. Pharmacol. 7:65-74. Dawson, T.P., and Witten, B., Bis (2-chloroethyl) methylamine, Preparation, Decontamination, and Stability, Technical Division Memorandum Report 442, Chemical Warfare Center, Edgewood Arsenal, MD, September 1942, UNCLASSIFIED Report (ADB960331). Dawson, T., and Witten, B., A Memorandum Report New Compounds 2,2’ Dichlorotriethylamine, Technical Division Memorandum Report 552, USA Chemical Research and Development Laboratories, Army Chemical Center, MD, February 1943, UNCLASSFIED Report (ADB960467). DHHS, Report on Carcinogens, Eleventh Edition, U.S. Department of Health and Human Services, 2002, pp. 706 DoD TM 3-215/AFM 355-7, Military Chemistry and Chemical Agents, December 1963, UNCLASSIFIED Technical Manual (ADA292141). DoD Chemical Agent Data Sheets, Vol. 1. Tech Rpt EO-SR-74001 (Edgewood Arsenal Special Report), AD B028222. Aberdeen Proving Ground, MD:U.S.Department of the Army, Edgewood Arsenal, 1974;167-179. DoD, NBC DECONTAMINATION, U.S. Department of Defense, 2000, pp. 229 Dudley, H.C., Wells, W.J.H.B. (1938). The detection of HS by odor. ADB 959500, EATR 249 Eisenmenger, W., Drasch, G., von Clarmann, M., Kretschmer, E., Roider, G. (1991). Clinical and morphological findings on mustard gas [bis(2-chloroethyl)sulfide] poisoning. J. Forensic Sci. 36: 1688–98. Elsayed, N., Omaye, S. (2006). Pulmonary biochemical alterations induced by systemic administration of nitrogen mustard. Toxicologist 90: 392. Felsing, W.A., et al., “The Melting Point of Mustard Gas,” J. Amer. Chem. Soc., Vol. 70, 1948. Franke, S., Manual of Military Chemistry Volume I- Chemistry of Chemical Warfare Agents, ACSI-J-3890, Chemie der Kampfstoffe, East Berlin, April 1968, UNCLASSIFIED Technical Manual (AD849866). Fuhr, I., Krakow, E.H. (1945). Median lethal concentrations of H for mice and rats. For various exposure times. MDR 21, March 21 Gerecke, D.R., Bhatt, P., Chang, Y. et. al. (2005). The matrix metalloproteinase inhibitor GM 1489 reduces MMp-9 activity after sulfur mustard exposure in vivo. Toxicologist 84 (S-1): 451. Gordon, R., Baker, K., Askins, L., Ratcliffe, R., Lindsay, D., Owens, R. et al. (2006). Chemical warfare agents (organophosphates and vesicant) and biological decontamination and detoxification using polyurethane sponges. Toxicologist 90: 393. Gray, P.J. (1989). A literature review on the mechanism of action of sulphur and nitrogen mustard. MRL Tech. Report MRLTR-89-24. DSTO Materials Research Laboratory, Victoria, Australia. Guild, W.J.F., K.P. Harrison, A.Fairley and A.E. Childs. 1941. The Effect of Sulfur Mustard on the Eyes. Porton Report 2297. Chemical Defense Experimental Station, Porton, UK. Hackett, P.L., R.L. Rommereim, F.G. Burton, R.L. Buschbom and L.B. Sasser. 1987. Teratology Studies on Lewisite and Sulfur Mustard Agents: Effects of Sulfur Mustard in Rats and Rabbits. Final Report. AD A187495. Pacific Northwest Laboratory, Richland, WA. Prepared for the U.S. Army Medical Research and Development Command, Fort Detrick, MD. Hambrook, J.L., D.J. Howells and C. Schock. 1993. Biological fate of sulphur mustard (1,1'-thiobis(2-chloroethane)): uptake, distribution and retention of 35S in skin and in blood after cutaneous application of 35S-sulphur mustard in rat and comparison with human blood in vitro. Xenobiotica 23:537-561. Hardej, D., Billack, B. (2006). Reduction of mechlorethamine cytotoxicity by ebselen in normal and tumor-derived cell lines. Toxicologist 90: 391 Harris, B.L., et al., Thickened Vesicants: Storage Stability of Unthickened and Thickened Nitrogen Mustards and Their Mixtures with Levinstein Mustard, Technical Division Memorandum Report 706, USA Chemical Research and Development Laboratories, Army Chemical Center, MD, July 1943, UNCLASSIFIED Report (ADB962153). Harris, B.L. and Macy, R., Corrosion by Vesicants: Rate of Corrosion of Steel and Other Metals by H, HQ, HN-3, HN-1, and L, Mostly at 65°C, Technical Division Memorandum Report 1031, USA Chemical Research and Development Laboratories, Army Chemical Center, MD, April 1945, UNCLASSIFIED Report (ADB963161). Haskin, D. (1948). Some effects of nitrogen mustards on the development of the external body form in the fetal rat. Anat. Rec. 102: 493–511. Heston WE. Induction of pulmonary tumors in strain A mice with methyl-bis (beta-chloroethyl)amine hydrochloride. J Natl Cancer Inst. 1949;10:125–130. Heston, W.E. 1950. Carcinogenic action of mustards. J. Natl. Cancer Inst. 11:415-423. Heston, W.E. 1953. Occurrence of tumors in mice injected subcutaneously with sulfur mustard and nitrogen mustard. J. Natl. Cancer Inst. 14:131-140. Heston, W.E. and W.D. Levillain. 1953. Pulmonary tumors in strain A mice exposed to mustard gas. Proc. Soc. Exp. Biol. 82:457-460. Hurst, C.G., Smith, W.J. (2008). Health effects of exposure to vesicant agents. In Chemical Warfare Agents, Chemistry, Pharmacology, Toxicology, and Therapeutics (J. Romano, Jr., B. Lukey, H. Salem, eds), pp. 293–312. CRC Press, Boca Raton, FL. IARC (International Agency for Research on Cancer). 1975. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man: Some Aziridines, N, S, & O-mustards and Selenium, vol. 9, pp. 181-207. International Agency for Research on Cancer, Lyons, France. IARC (International Agency for Research on Cancer). 1987a. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man: Genetic and Related Effects: An Updating of Selected IARC Monographs Volumes 1-42,Suppl. 6,International Agency for Research on Cancer, Lyons,France. IARC (International Agency for Research on Cancer). 1987b. IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man: Overall Evaluation of Carcinogenicity: An Updating of IOM (Institute of Medicine, Committee to Survey the Health Effects of Mustard Gas and Lewisite, Division of Health Promotion and Disease Prevention). 1993. Veterans at Risk; The Health Effects of Mustard Gas and Lewisite, C.M. Pechura and D.P. Rall, eds. National Academy Press, Washington,DC. Keyes, D.C., Burstein, J.L., Schwartz, R.B., Swienton, R.E. (eds) (2005). Medical Response to Terrorism. Lippincott Williams & Wilkins, Philadelphia, PA. Kibler, A.L., Data on Chemical Warfare, Technical Division Memorandum Report 456, Chemical Warfare Center, Edgewood Arsenal, MD, November 1942, UNCLASSIFIED Report (ADB969725) Kirner W.R., Summary Technical Report of Division 9, NDRC Volume 1, Chemical Warfare Agents, and Related Chemical Problems Part I-II, Office of Scientific Research and Development, Washington, DC, 1946, UNCLASSIFIED Report (AD234270). MacNaughton, M. G.; Brewer, J. H. EnVironmental Chemistry and Fate of Chemical Warfare Agents;Southwest Research Institute: San Antonio TX, 1994. Mancheco, A.M., Brimfield, A.A. (2006). Interaction of sulfur mustard with NADPH-cytochrome P450 reductase and cytochrome P450 isoforms. Toxicologist 90: 391. Miccadei, S., Kyle, M.E., Gilfor, D., Farber, J.L. (1988). Toxic consequences of the abrupt depletion of glutathione in cultured rat hepatocytes. Arch. Biochem. Biophys. 265: 311–20. Moelwyn-Hughes, E.A., and Owens, R., The Surface Tension, The Molecular Surface Energy and the Parachor of Toxic Compounds and of Certain Chlorides Used in Their Manufacture, Part XV of the Thermal Decomposition of the Secondary Alkylflurophosphonites, Sutton Oak Report 544, Sutton Oak, England, September 1941, UNCLASSIFIED Report. Munro NB, Watson AP, Ambrose KR, Griffin GD. Treating exposure to chemical warfare agents: implications for health care providers and community emergency planning. Environ Health Perspect 89:205-215 (1990). Murphy, M.L., Del Moro, A., Lacon, C. (1958). The comparative effects of five polyfunctional alkylating agents on the rat fetus, with additional notes on the chick embryo. Ann. NY Acad. Sci. 68: 762–82. NATO, NAVMED P-5059 NATO Handbook on the Medical Aspects of NBC Defensive Operations, NATO Headquarters, 1996, pp. 286 NDRC (National Defense Research Committee) (1944). Geiling, E.M.K., Cannan, R.K., Bloom, W. Toxicity of chemical warfare agents. NDRC-IMPR-9-4-1-17. June 1944. NDRC (National Defense Research Committee) (1945). The penetration of vesicant vapors into human skin. Rockefeller Inst. Med. Res. OSRD Report No. 4855, March 24, 1945. NRC (National Research Council). 1999. Review of the U.S. Armys Health Risk Assessments for Oral Exposure to Six Chemical-Warfare Agents. Committee on Toxicology, National Research Council, Washington, DC. NRC (National Research Council) (2003). Acute Exposure Guideline Levels for Selected Airborne Chemicals. Subcommittee on Chronic Reference Doses for Selected Chemical-Warfare Agents, Committee on Toxicology, Board on Environmental Studies and Toxicology, Commission on Life Sciences, National Research Council. National Academy Press, Washington, DC. Reed, C.I. 1918. The Minimum Concentration of Mustard Gas Effective for Man (Preliminary Report), Report No. 318. Pharmacology Research Section, American University. Reed, C.I. 1920. The Minimum Concentration of Dichlorethylsulfide (Mustard Gas) Effective for Man. J. Pharm. Exp. Therap. 15:77-80. Reed, C.I., E.F. Hopkins and C.F. Weyand. 1918. The Minimum Concentration of Mustard Gas Effective for Man (Final Report). Report No. 329, War Department, Medical Division, C.W.S., Pharmacology Research Section, American University Experiment Station, Washington, D.C. Papirmeister, B., A.J. Feister, S.I. Robinson and R.D. Ford. 1991. Medical Defense Against Mustard Gas: Toxic Mechanisms and Pharmacological Implications. CRC Press, Boca Raton, FL. 359 pp. Penski, E.C., Properties of Di-(2-Chloroethyl) Sulfide I. Vapor Pressure Data Review and Analysis, ERDEC-TR-043, USA Edgewood Research, Development and Engineering Reference-12 Center, Aberdeen Proving Ground, MD, April 1993, UNCLASSIFIED Report (ADA267059). Renshaw, B. (1947). Observations on the role of water in the susceptibility of human skin to injury by vesicant vapors. J. Invest. Dermatol. 9: 75–85. Roberts, J.J. and G.P. Warwick. 1963. Studies of the mode of the action of alkylating agents - VI. The metabolism of bis-ß-2-chloroethylsulphide (mustard gas) and related compounds. Biochem. Pharmacol. 12:1329-1334. Romano, J.A., Lukey, B.J., Salem, H. (2008). Chemical Warfare Agents: Chemistry, Pharmacology, Toxicology, and Therapeutics. CRC Press, Boca Raton, FL. Rosenblatt DH, Miller TA, Dacre JC, Muul I, Cogley DR. Problem Definition Studies on Potential Environmental Pollutants. II. Physical, Chemical, Toxicological, and Biological Properties of 16 Substances. Tech Rpt 7509; AD AD30428. Fort Detrick, MD:U.S. Army Medical Bioengineering Research and Development Laboratory, 1975. Rosenblatt DH, Small MJ, Kimmell TA, Anderson AW. Agent Decontamination Chemistry: Technical Report. U.S. Army Test and Evaluation Command (TECOM) Technical Support, Phase 1. Prepared for the Environmental Quality Office, U.S. Army Test and Evaluation Command, by Argonne National Laboratory, Washington, DC, 1995. Ruth, J.H. (1986). Odor thresholds and irritation levels of several chemical substances: a review. Am. Ind. Hyg. Assoc. J. 47: A-142–51. Samuel, J.B., et al., Physical Properties of Standard Agents, Candidate Agents, and Related Compounds at Several Temperatures (U), ARCSL-SP-83015, USA Armament Research and Development Command, Aberdeen Proving Ground, MD, June 1983, UNCLASSIFIED Report (ADC033491). Sasser L.B., R. A. Miller, D.R. Kalkwarf, et al. 1989a. Toxicology Studies on Lewisite and Sulfur Mustard Agents: Subchronic Toxicity of Sulfur Mustard (HD) in Rats. Final Report , PNL-6870, Pacific Northwest Laboratories, Richland, WA. Prepared for the U.S. Army Medical Research and Development Command, Fort Detrick, MD. Schier, J.G., Hoffman, R.S. (2005). Equipment preparedness for terrorism. In Medical Response to Terrorism (Keyes, D.C., Burstein, J.L., Schwartz, R.B., Swienton, R.E., eds), pp. 284–92. Lippincott Williams & Wilkins, Philadelphia, PA. Shakil, F.A., A. Kuramoto, M. Yamakido, et al. 1993. Cytogenetic abnormalities of hematopoietic tissue in retired workers of the Ohkunojima poison gas factory. Hiroshima J. Med. Sci. 42:159-165. Sidell, F.R. and C.G. Hurst. 1992. Clinical Considerations in Mustard Poisoning. In: Chemical Warfare Agents. A.M. Somani, ed., pp. 51-67, Academic Press, New York. Smith, M.G., Stone, W., Ren-Feng, G. et al. (2008). Vesicants and oxidative stress. In Chemical Warfare Agents, Chemistry, Pharmacology, Toxicology, and Therapeutics (J. Romano, Jr., CHAPTER 8 $ Mustards and Vesicants 107 B. Lukey, H. Salem, eds), pp. 293–312. CRC Press, Boca Raton, FL. Somani, S. M.; Babu, S. R. Toxicodynamics of Sulfur Mustard. Int. J. Clin. Pharm. Therap. Toxicol. 1989, 9, 419–435; Somani, S.M. 1992. Toxicokinetics and toxicodynamics of mustard. In: Chemical Warfare Agents. A.M. Somani, ed., pp. 13-50, Academic Press, New York. USACHPPM (US Army Center for Health Promotion and Preventive Medicine) (1996). Detailed and general facts about chemical agents – TG 218. USACHPPM, Aberdeen Proving Ground, MD. USACHPPM TG No. 218. October 1996. USACHPPM (US Army Center for Health Promotion and Preventive Medicine) (1999). Derivation of health-based environmental screening levels for chemical warfare agents: a technical evaluation. Aberdeen Proving Ground, MD. USACHPPM (US Army Center for Health Promotion and Preventive Medicine) (2000). Evaluation of airborne exposure limits for sulfur mustard: occupational and general population exposure criteria. Aberdeen Proving Ground, MD. Technical Report 47-EM-3767-00. USACHPPM (US Army Center for Health Promotion and Preventive Medicine) (2004). Acute toxicity estimation and operational risk management of chemical warfare agent exposures. USACHPPM Report No. 47-EM-5863-04. USACHPPM, Aberdeen Proving Ground, MD. May 2004. USACS, Potential Military Chemical/Biological Agents and Compounds, US Army Chemical School, 2001, pp. 130 Vijayaraghavan, R. 1997. Modifications of breathing pattern induced by inhaled sulphur mustard in mice. Arch. Toxicol. 71:157-164. Watson AP, Ambrose KR, Friffin GD, Leffingwell SS, Munro NB, and Waters LC, “Health Effects of Warfare Agent Exposure: Implications for Stockpile Disposal,” Environ Prof, 11, 1989, pp. 335–353. Watson AP, and Griffin GD, “Toxicity of Vesicant Agents Scheduled for Destruction by the Chemical Stockpile Disposal Program,” review, Environ Health Perspect, 98, 1992, pp. 259–280. Williams, A.H., “The Thermal Decomposition of 2:2’-Dichlorodiethyl Sulphide,” J. Chem. Soc., 1947. Wils, E.R.J., A.G. Hulst and J. Van Laar. 1988. Analysis of thiodiglycol in urine of victims of an alleged attack with mustard gas. Part. II. J. Anal. Toxicol. 12:15-19. Witten, Benjamin, The Search for Toxic Chemical Agents (U), EATR 4210, Edgewood Arsenal Research Laboratories, MD, November 1969, UNCLASSIFIED Report (AD507852). Yang, Y., Baker, J., and Ward, J. “Decontamination of chemical warfare agents”, Chem. Rev., 92, 1729-1743 (1992). Yang, Y., et al., “Characterization of HD Heels and the Degradation of HD in Ton Containers,” In Proceedings of the 1996 ERDEC Scientific Conference on Chemical and Biological Defense Research 19-22 November 1996, UNCLASSFIED Paper, ERDEC-SP-048, USA Edgewood Research, Development and Engineering Center, Aberdeen Proving Ground, MD, October 1997, UNCLASSFIED Report (ADA334105). Young, L., J.A. McCarter, M. Edson and E. Estok. 1944. Biochemical Experiments with Mustard Gas Prepared from Radioactive Sulfur. V. The Systemic Distribution of 35S at Different Times after Application of Radioactive Mustard Gas to the Skin of the Rat. University of Toronto, Report No. 17, C.P. 75. Zajtchuk R., Textbook of Military Medicine: Medical Aspects of Chemical and Biological Warfare, U.S. Department of Defense, 2000, pp. 721
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||